PHOTOS
VIDÉOS
DOSSIERS
COMPRENDRE
MBELL
OUTILS
ANNEXE
DOSSIER - Les Hydrométéores Orageux : Partie 1
 Dossier Foudre - Sommaire
Dossier Foudre - Sommaire
- 1. Introduction
- 2. DOSSIER - Foudre - Hydrométéores Partie 1 - Cumulonimbus / Vapeur d'Eau
Avant d’étudier la foudre, il faut nous intéresser d’abord aux orages qui la provoque et plus particulièrement encore, aux hydrométéores qui composent le nuage orageux. Si le sujet des structures orageuses et de la formation des orages vous intéresse, je vous invite à consulter mon précédent dossier : le classement des orages.
1. Cumulonimbus et Hydrométéores
1.1. Orage Froid
Un nuage orageux est un nuage froid. En effet sa limite inférieure, celle où sa base nuageuse commence, appelée niveau de condensation de convection, peut varier d’une situation à une autre et en fonction surtout de l’humidité présente en basse couche, mais en moyenne on s’accorde à dire que le plafond d’un orage commence vers 1 500m d’altitude environ. A cette hauteur, en plein été orageux, l’air est encore autour des 15-20°C en moyenne. Un orage cependant est un nuage à fort développement vertical, il s’étend donc jusqu’à son niveau d’équilibre convectif, situé en moyenne jusqu’à 12 000m d’altitude l’été en zone tempérée (de 8km d’altitude environ l’hiver en zone tempérée jusqu’à 20km d’altitude environ sur l’équateur). Ainsi la zone limite de congélation se situe en moyenne vers les 3 000m d’altitude l’été (évidemment plus basse encore en hiver), ce qui laisse donc plus des 3/4 de sa hauteur située sous la température de 0°C. Un orage est donc bel et bien froid, même en plein été sous les tropiques et alors que près du sol on peut dépasser les 30°C.
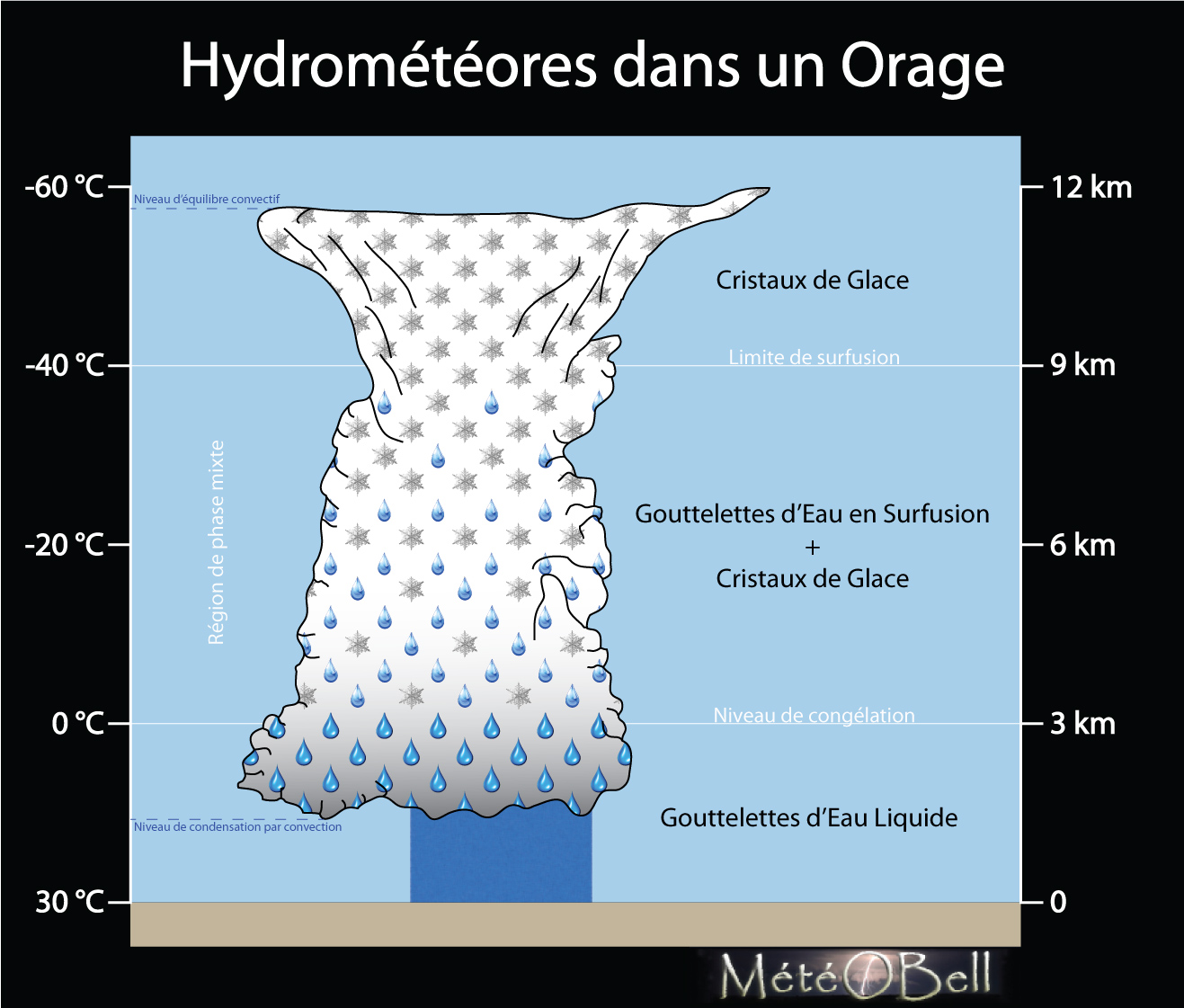
1.2. Niveau de Congélation
Un orage, comme tous les nuages est composé de milliards de gouttelettes d’eau à différents états liquide ou solide en fonction de la température, de l’humidité et même de la pression. C’est la raison pour laquelle on parle plutôt d’hydrométéores, car les composants des nuages peuvent prendre de nombreuses formes géométriques différentes en fonction de ces états et peuvent en fonction de leurs tailles soit être en suspension dans l’air, soit précipitant. Nous n’aborderons que brièvement dans ce dossier les mécanismes de précipitation orageux (qui mériteraient un dossier à part entière) et nous parlerons donc ici essentiellement des hydrométéores en suspension dans l’air, car ce sont eux surtout qui vont aider à comprendre comment se forme la foudre. Ainsi en résumant, au-dessus de la température de 0°C (- de 3 000 m d’altitude), les gouttelettes d’eau en suspension seront toutes sous formes liquides, et en-dessous de 0°C (+ de 3 000 m), les gouttelettes d’eau commenceront à se transformer en cristaux de glace. C’est la vision classique que nous connaissons tous, celle où l’eau gèle à partir du niveau de congélation de 0°C, situé autour des 3 000m d’altitude.
1.3. Région de Phase Mixte
En fait l’eau peut rester liquide sous les 0°C. Elle peut même rester liquide jusqu’à -40°C environ (-38/-39°C pour être exact). On appelle cela un état de surfusion. Nous sommes peu habitué à cet état particulier de l’eau car il est peu fréquent au sol, mais dans l’atmosphère il est très courant, c’est même la norme dans une couche situé entre 0°C et -40°C, c’est à dire entre 3 000 m et 9 000 m d’altitude (environ), c’est à dire dans pratiquement toute la partie centrale d’un orage, ce qui représente plus de la moitié de son épaisseur. Toutes les gouttelettes d’eau ne sont pas surfondus dans cette zone et une grande partie se cristallise tout de même en glace, ce qui fait que cette zone centrale des orages située entre 0°C et -40°C est une région de phase mixte liquide-solide. Évidemment plus on se rapproche des 0°C, moins on trouve de cristaux de glace et plus on se rapproche des -35/-40°C, moins on trouve de gouttelette liquide en surfusion. Finalement pour ne retrouver que des cristaux de glace, il faut que la température de l’air descende en-dessous des -35/-40°C, ce qui ne représente que la partie haute des orages, la zone d’enclume, car la tropopause, limite supérieur de la formation des nuages, ne descend que rarement en-dessous des -60°C (-56°C en moyenne en zone tempérée / -80°C en zone équatoriale). Ainsi la partie importante du nuage, tant pour la formation des précipitations que pour l'électrification, est la région moyenne, mixte. On y trouvera à la fois des cristaux de glace et des gouttelettes d'eau surfondues.
1.4. Surfusion
 La surfusion est un état liquide métastable. Un état métastable veut dire qu’il a l’apparence de la stabilité (liquide), mais que la moindre petite perturbation va déclencher très rapidement un autre état qui restera lui définitivement stable (solide). Pour prendre une comparaison, un état métastable, c’est un peu comme une pierre au repos qui se trouverait juste au bord d’une pente abrupte. Tant qu’aucune perturbation ne vient déranger la pierre, celle-ci reste imperturbable en haut de la pente. Poussez-la très légèrement et elle descend de plusieurs centaines de mètres la pente, sans jamais avoir la possibilité de la remonter. L’état liquide en surfusion est comme cette pierre en haut de la pente. Une gouttelette d’eau surfondue peut rester liquide indéfiniment jusqu’à -40°C tant qu’aucune perturbation ne vient la déranger. La moindre perturbation en revanche et la gouttelette va geler instantanément de manière définitive (sauf si vous revenez à des températures positives supérieures à 0°C bien sûr). Nous verrons plus tard le type de perturbation qui permet de geler une gouttelette liquide en surfusion, lorsque nous aborderons le sujet des cristaux de glace.
La surfusion est un état liquide métastable. Un état métastable veut dire qu’il a l’apparence de la stabilité (liquide), mais que la moindre petite perturbation va déclencher très rapidement un autre état qui restera lui définitivement stable (solide). Pour prendre une comparaison, un état métastable, c’est un peu comme une pierre au repos qui se trouverait juste au bord d’une pente abrupte. Tant qu’aucune perturbation ne vient déranger la pierre, celle-ci reste imperturbable en haut de la pente. Poussez-la très légèrement et elle descend de plusieurs centaines de mètres la pente, sans jamais avoir la possibilité de la remonter. L’état liquide en surfusion est comme cette pierre en haut de la pente. Une gouttelette d’eau surfondue peut rester liquide indéfiniment jusqu’à -40°C tant qu’aucune perturbation ne vient la déranger. La moindre perturbation en revanche et la gouttelette va geler instantanément de manière définitive (sauf si vous revenez à des températures positives supérieures à 0°C bien sûr). Nous verrons plus tard le type de perturbation qui permet de geler une gouttelette liquide en surfusion, lorsque nous aborderons le sujet des cristaux de glace.
La raison pour laquelle la surfusion existe vient du fait que pour que le premier germe de solidification se forme au sein de la gouttelette, elle doit pouvoir perdre de l’énergie et que cette énergie en trop doit pouvoir s’échapper de la gouttelette d’eau. En effet si l’eau gèle c’est qu’elle a perdu une certaine quantité d’énergie et donc on doit retrouver obligatoirement quelque-part cette énergie perdu. C’est le principe de la chaleur latente de fusion, où lors des changements de phase des états de la matière, rien ne peux se créer et rien ne peux se perdre, tout se transforme (c’est la première loi de la thermodynamique). Normalement cette énergie perdu devrait pouvoir se retrouver dans l’air environnant en dehors de la gouttelette d’eau, mais la tension superficielle est telle autour d’une gouttelette d’eau que cette chaleur n’arrive jamais à en sortir. Cette énergie qui reste piégée dans la gouttelette refond donc à chaque fois ce premier germe de solidification, la gouttelette n’arrive jamais à se débarrasser de cette énergie en trop pour passer dans un état de cristal de glace.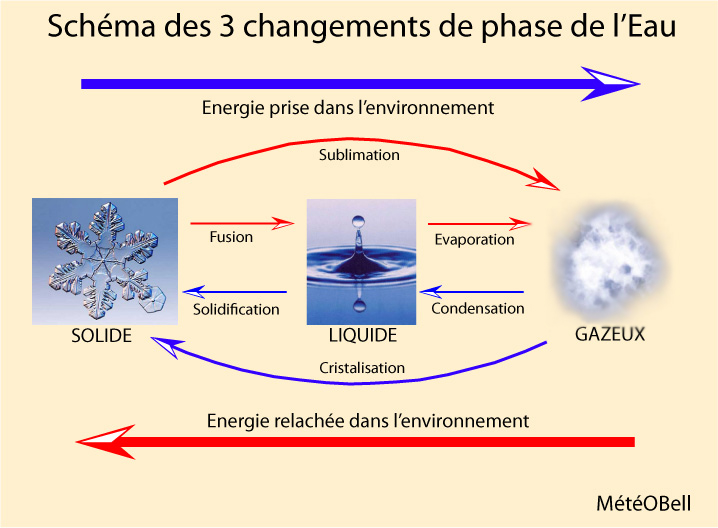
2. Vapeur d’Eau
La première chose à savoir, qui peut paraitre évidente mais est bonne à rappeler, c’est qu’un nuage n’est pas de la vapeur d’eau. La vapeur d’eau est invisible. Un nuage est constitué de millions de micro-gouttelettes d’eau à l’état liquide et/ou solide. La vapeur d’eau est cependant présente également dans le nuage et joue d’ailleurs un rôle primordiale dans les mécanismes de formation des nuages. La vapeur est contenue dans l’air entre les gouttelettes d’eau (et cristaux de glace) ; dans les interstices. Ainsi dans la région de phase mixte situé entre 0 et -40°C, nous avons de l’eau dans ces 3 états en même temps : solide, liquide et gazeuse. Nous allons d’abord étudier sa forme gazeuse, à travers 3 notions importantes : l’évaporation, la pression de vapeur et l’humidité relative.
2.1. Ébullition
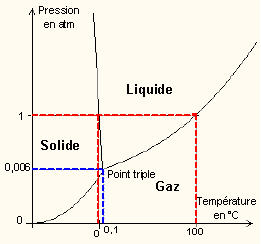 Il y a souvent confusion entre l’ébullition et l’évaporation. Comme tout le monde le sait, l’eau bout à 100°C. En fait l’eau entre en ébullition à 100°C à la pression de 1 atmosphère, ce qui correspond à la pression terrestre à la surface de la mer, soit 1015hpa environ. La température d’ébullition dépend donc également de la pression atmosphérique. A 3 000m par exemple l’eau entre en ébullition à 90°C. A 9 000m, 70°C. Pour qu’elle bout à température ambiante, soit 20°C, il faudrait que la pression descende à seulement 0.02 atmosphère, c’est à dire la pression qu’on trouve à 23 000m d’altitude (on peut le faire avec une simple cloche à vide). Et que se passe t’il si l’on fait baisser la pression pour que l’ébullition ait lieu à 0°C ? L’eau se trouve alors dans les 3 états en même temps et passe de l’état liquide, à solide et gazeux en même temps, c’est le point triple. Si l’on fait encore baisser la pression, la phase liquide disparait et l’on passe directement de l’état solide à gazeux.
Il y a souvent confusion entre l’ébullition et l’évaporation. Comme tout le monde le sait, l’eau bout à 100°C. En fait l’eau entre en ébullition à 100°C à la pression de 1 atmosphère, ce qui correspond à la pression terrestre à la surface de la mer, soit 1015hpa environ. La température d’ébullition dépend donc également de la pression atmosphérique. A 3 000m par exemple l’eau entre en ébullition à 90°C. A 9 000m, 70°C. Pour qu’elle bout à température ambiante, soit 20°C, il faudrait que la pression descende à seulement 0.02 atmosphère, c’est à dire la pression qu’on trouve à 23 000m d’altitude (on peut le faire avec une simple cloche à vide). Et que se passe t’il si l’on fait baisser la pression pour que l’ébullition ait lieu à 0°C ? L’eau se trouve alors dans les 3 états en même temps et passe de l’état liquide, à solide et gazeux en même temps, c’est le point triple. Si l’on fait encore baisser la pression, la phase liquide disparait et l’on passe directement de l’état solide à gazeux.
Tension de Vapeur Saturante du Liquide
En fait, on dit que lorsque la tension de vapeur saturante de l’eau sous forme liquide (TVSL) est égale (ou supérieur) à la pression atmosphérique, l’ébullition se produit. Cette tension de vapeur saturante de l’eau est une force qui est proportionnelle à la température. Lorsque cette force a vaincu celle de la pression atmosphérique, alors les molécules d’eaux passent de l’état liquide à gazeux. Il y a même formation de bulle de vapeur au sein même du liquide.
Tension / Pression
La TVSL correspond à une pression, mais par convention pour éviter les confusions, on parle de tension quand il s’agit d’un liquide (ou d’un solide) et de pression quand il s’agit d’un gaz. Ainsi dit autrement, la tension de vapeur saturante de l’eau liquide est donc la pression exercée par l’eau liquide pour entrer en phase gazeuse saturé d’humidité. Lorsque cette tension est supérieur à la pression atmosphérique, il n’y a plus rien pour empêcher l’eau liquide d’entrer entièrement en vapeur d’eau, c’est l’ébullition. Il y a alors vaporisation rapide de l’eau, avec formation de bulle de vapeur.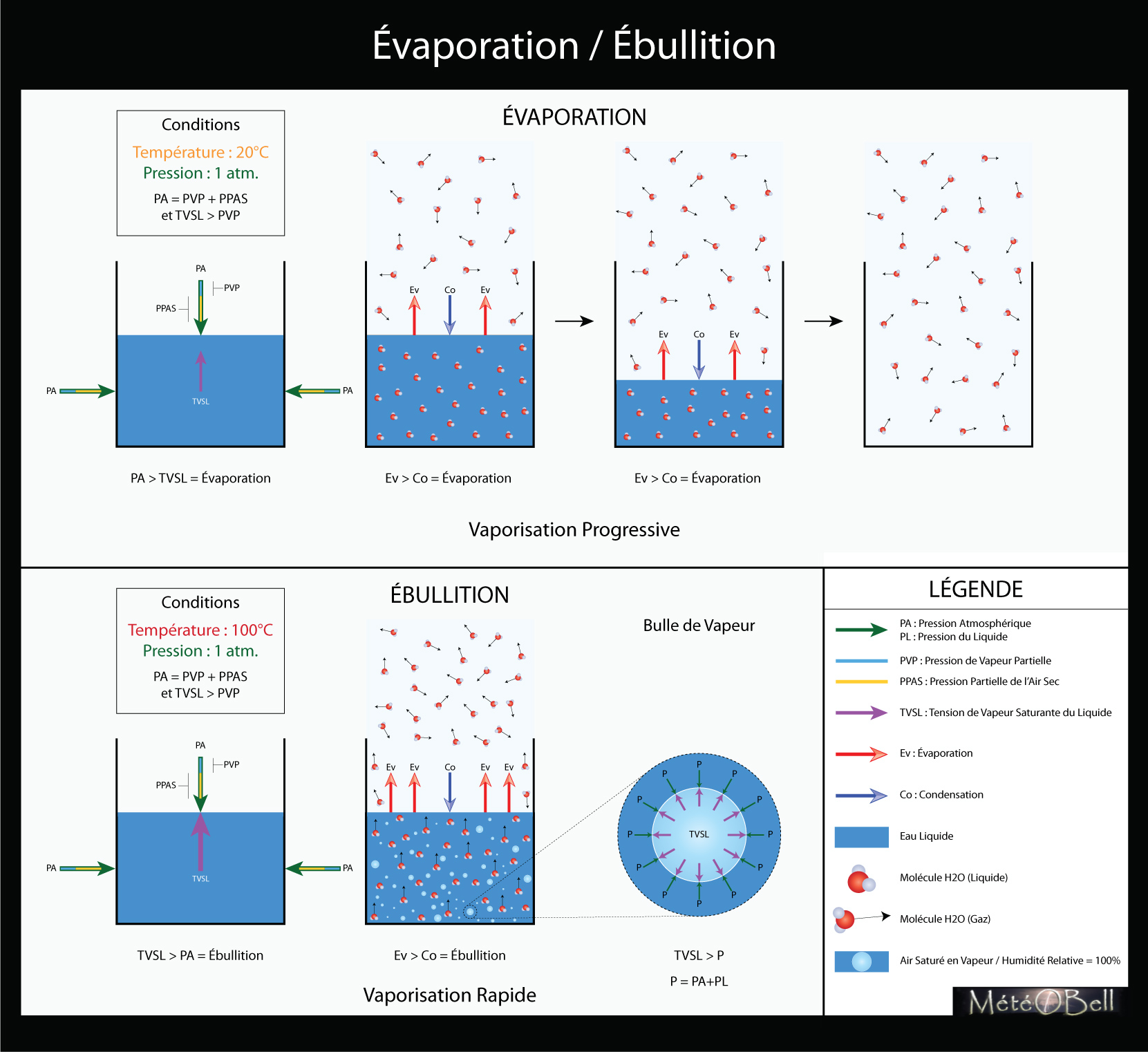
2.2. Évaporation
Mais l’eau peut aussi s’évaporer à des températures bien inférieures. Elle peut même s’évaporer lorsqu’elle est en surfusion donc à des températures négatives. Surprenant ? En fait l’ébullition est différente de l’évaporation. Dans une eau qui est en ébullition c’est tout le volume de l’eau dans son entièreté qui s’évapore et de manière violente, très rapide. L’évaporation ne se produit quant à elle, qu’à la surface de l’eau, au niveau de la zone de contact liquide-air et se déroule de manière assez lente. C’est une vaporisation progressive. On le constate tous les jours lorsqu’on voit les flaques d’eau s’évaporer sur la route après une pluie. Comme cela dépend de la surface en contact avec l’air, plus la flaque est étiré, plus elle se vaporise vite. Comme pour l’ébullition, cette évaporation de surface va dépendre également de la température et de la pression de l’air, mais plus précisément de la pression de vapeur partielle de l’air, c’est à dire de la fraction correspondant au taux d’humidité de l’air de la pression atmosphérique.
Pression Partielle
En effet la pression atmosphérique peut être divisé en plusieurs pressions partielles. Il y a la pression partielle de l’air sec qui correspond à la fraction de l’air de tous les gazs dissous dans un air sec (azote, oxygène...) et la pression de vapeur partielle qui correspond à la fraction de l’air contenant l’eau sous forme de vapeur. En fait il y a toujours une partie de cette vapeur contenu dans l’air qui se condense sous forme liquide. Chaque fois qu’une molécule de vapeur entre par hasard en contact avec la surface d’un liquide, elle se condense dans le liquide. On parle d’un taux de condensation. Mais en même temps il y a toujours une partie de l’eau liquide qui s’évapore sous forme de vapeur à la surface. On parle d’un taux d’évaporation.
Taux d’Évaporation
Dans les conditions standards où l’air n’est pas saturé d’humidité, le taux d’évaporation sera toujours supérieur au taux de condensation (nous verrons dans le chapitre suivant dédié à la pression de vapeur pourquoi). Il y a donc évaporation du liquide jusqu’à sa vaporisation complète et jusqu’à ce qu’il n’y ait plus de liquide à évaporer. Évidemment plus la température du liquide est importante, plus le taux d’évaporation est important. Et cela fonctionne aussi avec l’eau en surfusion ou l’eau sous forme solide (glace), puisque plus l’air est chaud en comparaison et/ou plus l’air est sec, moins le taux de condensation est important et donc plus il y a évaporation. L’évaporation inexorable d’un liquide à l’état naturel (en milieu ouvert) est donc la norme. Cela prendra simplement plus ou moins de temps en fonction des conditions de température (eau-air) et d’humidité (air).
2.3. Pression de Vapeur
Cependant pour que des gouttelettes se forment en nuage il faut que le taux de condensation dans ce processus soit plus important. Le rôle de la pression de vapeur partielle dans ce processus est primordiale. On dit que cette pression de vapeur est partielle, simplement pour se souvenir qu’il ne correspond qu’à une fraction de la pression de l’air, la vapeur étant mélangé à d’autres gazs constituant l’air (pression partielle de l’air sec).
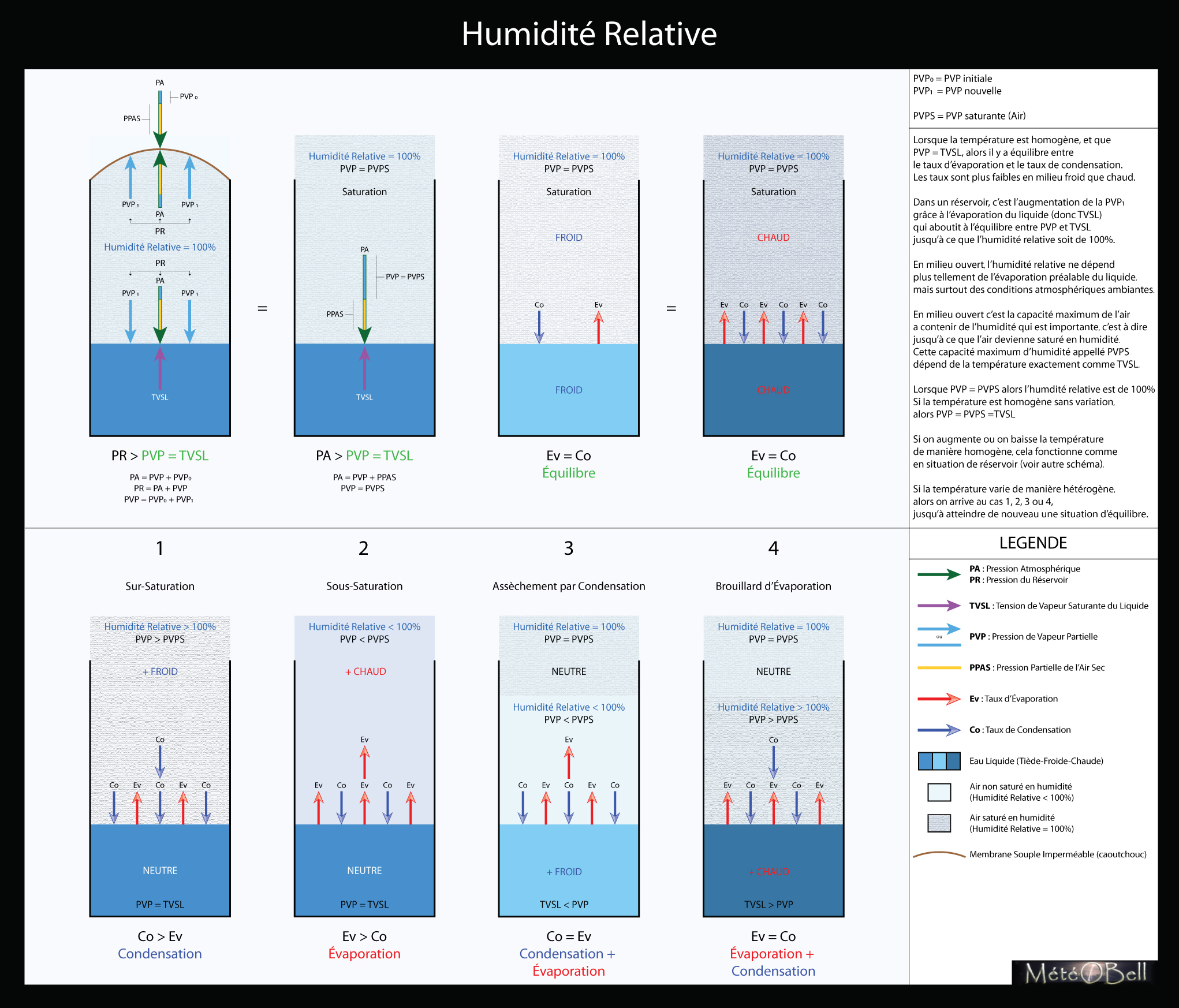
Milieu Fermé
Pour comprendre le rôle de la pression de vapeur, prenons d’abord comme exemple un milieu clos, comme un réservoir d’eau à moitié rempli et dont le haut serait fermé hermétiquement par une membrane souple (en caoutchouc par exemple). L’eau contenu dans ce réservoir va donc pour les raisons expliqués dans le paragraphe précédent également lentement s’évaporer à sa surface, comme il le ferait en milieu ouvert. Au lieu de s’échapper et disparaitre dans l’environnement, la vapeur d’eau va cependant ici remplir peu à peu le volume d’air situé dans la partie haute du réservoir, sans réussir à s’en aller. Ce n’est pas qu’une expérience de pensée, ceci arrive vraiment dans la plupart des liquides. Si on ne fermait pas nos bouteilles d’eau avec un bouchon et qu’on les laissait suffisamment longtemps (très longtemps, compte tenu du peu de surface dans une bouteille d’eau), probablement qu’elles s’évaporeraient totalement.
Pression de Vapeur Partielle Nouvelle
Dans notre réservoir fermé cependant, la vapeur va s’accumuler lentement. En fait plus le volume d’air va se remplir de vapeur lors de l’évaporation du liquide, plus cette vapeur supplémentaire va exercer une certaine pression. La membrane en caoutchouc commence à se soulever car cette pression de vapeur se rajoute à la pression atmosphérique. Il y a donc déséquilibre entre la paroi intérieure et extérieure de la membrane. Cette pression de vapeur partielle nouvelle se rajoute à la pression partielle initiale contenue dans la pression atmosphérique. On connait bien ce phénomène dans les boissons gazeuses où on rajoute en plus du gaz carbonique dissout dans l’eau. Mais ce phénomène existe comme nous le voyons aussi dans l’eau plate. Comme la force de cette pression va évoluer avec la température c’est cette capacité qui était utilisé dans les machines à vapeur. En effet à de haute température, la force de cette pression peut être très importante.
Équilibre Évaporation-Condensation
Cependant il va arriver un moment où ce volume d’air ne pourra plus contenir d’avantage de vapeur. Cette capacité maximum de l’air dépend de la température. Plus l’air est chaud, plus il peut contenir de vapeur, plus la pression de vapeur peut être importante dans un volume d’air donné. Aussi lorsque cette pression va atteindre son niveau maximum (en fonction de la température), l’évaporation du liquide va cesser, car cela se matérialisera par un équilibre entre le taux d’évaporation et le taux de condensation.
Conditions de Température Homogène
Cet équilibre ne peut être atteint que lorsque la température entre le volume d’air et le liquide est le même. En effet si un changement de température a lieu entre l’un ou l’autre alors il y aura de nouveau déséquilibre et soit le taux de condensation, soit le taux d’évaporation prendra le dessus jusqu’à atteindre de nouveau un autre équilibre et une température homogène (nous verrons cela dans le prochain paragraphe dédié à l’humidité relative). Dans notre expérience du réservoir, pour faciliter la compréhension des choses, nous considérons cependant que notre température est toujours homogène dans le réservoir et est donc la même dans l’air que dans l’eau liquide à tout moment. Ainsi, la tension de vapeur saturante du liquide (TVSL) évolue de la même façon en fonction de la température que la pression de vapeur saturante de l’air (c’est à dire la capacité maximale d’absorption de vapeur d’un volume d’air). Pour qu’il y ait équilibre cependant, la température homogène ne suffit pas, puisqu’au début de notre expérience c’était également le cas lorsqu’il y avait évaporation. En effet au début de l’expérience, la pression de vapeur partielle n’est pas encore saturante et n’a donc pas encore atteint la valeur de la TVSL.
Évaporation ou Condensation
En fait dans les conditions où la température est homogène (air-liquide), alors l’équilibre est atteint dans le réservoir lorsque la tension de vapeur saturante du liquide (TVSL) est égale à la pression de vapeur partielle de l’air (PVP). On dit alors que la pression de vapeur est saturante. En fait on peut résumer simplement les choses ainsi :
- Si la pression de vapeur partielle est inférieure à la tension de vapeur saturante du liquide, une portion du liquide ou du solide passe sous forme gazeuse (évaporation, vaporisation ou sublimation).
- Si la pression de vapeur partielle est supérieure à la tension de vapeur saturante du liquide, une portion de la vapeur passe sous forme liquide ou solide (liquéfaction, condensation solide).
Résumé de l’Expérience
Au début de l’expérience, il y a évaporation car TVSL > PVP. Puis la pression de vapeur s’accumulant dans le réservoir, nous arrivons à un équilibre avec TVSL = PVP. La pression de vapeur devient saturante car elle a alors atteint son niveau maximal à une température donnée. Si on baisse la température du réservoir, alors TVSL < PVP, l’air dans le réservoir devient sur-saturé car sa capacité maximale d’absorption de vapeur baisse également avec la température, et une partie de la vapeur doit se condenser pour atteindre un nouvel équilibre à la nouvelle température donnée. Si on augmente la température du réservoir, alors TVSL > PVP de nouveau jusqu’à de nouveau atteindre un équilibre à la nouvelle température donnée. La vapeur peut de nouveau se former dans l’air puisque la capacité maximale de vapeur que l’air peut contenir augmente aussi avec la température.
Cas Particulier : Surébullition
Si j’augmente la température jusqu’au point d’ébullition correspondant à la pression atmosphérique ambiante (100°C pour 1 atmosphère par exemple), on va constater que cela ne peut pas avoir lieu car pour que l’ébullition se forme, TVSL doit être supérieur à la pression globale du réservoir, or celui-ci contient maintenant bien plus de pression que celui de l’atmosphère. L’ébullition ne pourra avoir lieu qu’à une température correspondant à cette nouvelle pression du réservoir, c’est à dire plus de 100°C, c’est le principe de l’autocuiseur (ou cocote-minute). On appelle cela la surébullition (ou surchauffe).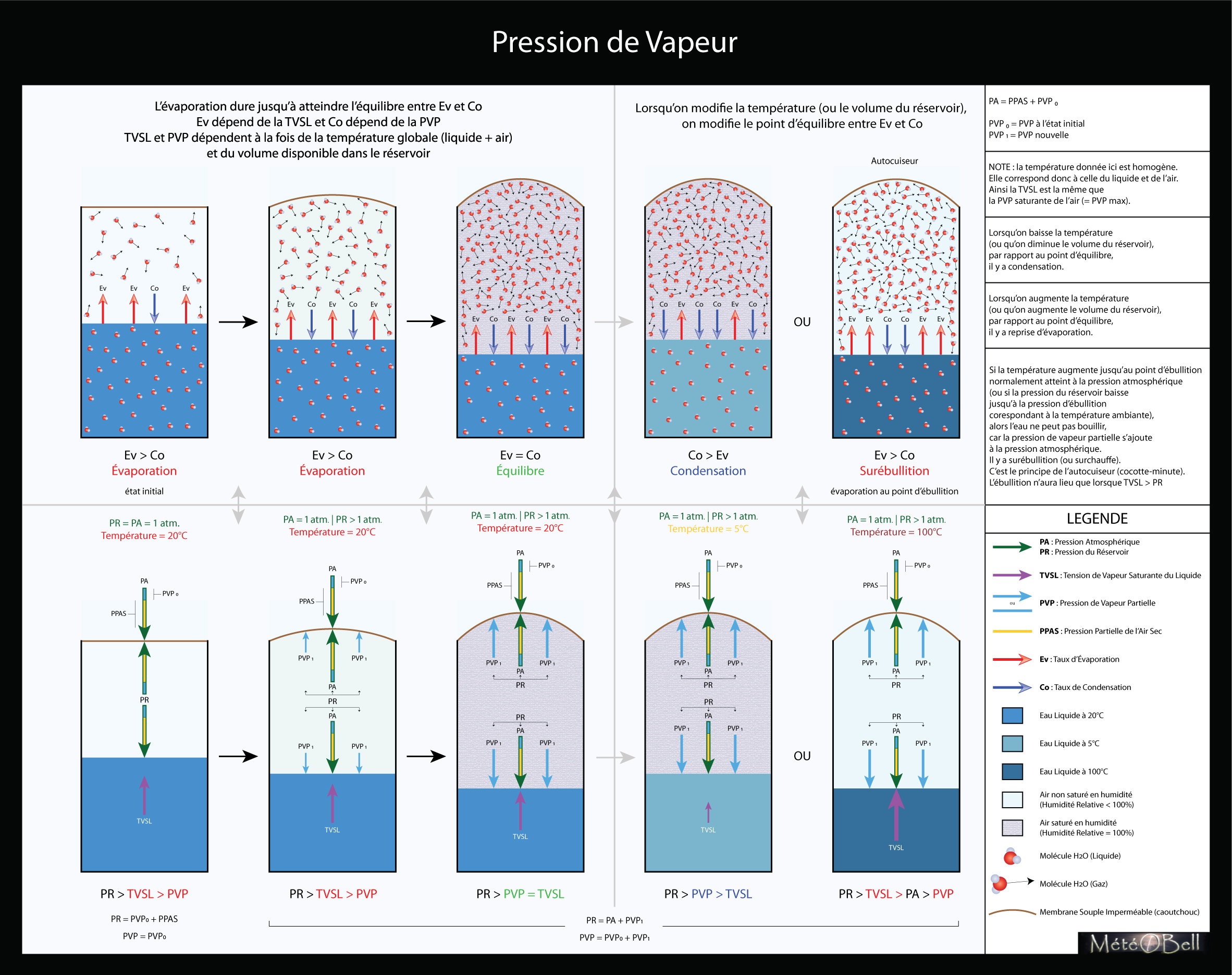
2.4. Humidité Relative
En fait la notion de pression de vapeur s’utilise surtout dans des milieux fermés, mais en météorologie nous évoluons en milieu ouvert et l’augmentation de cette pression de vapeur ne dépend plus tellement de l’évaporation du liquide (sauf lorsque nous regardons à l’échelle microscopique comme avec l’effet Bergeron), mais dépend plutôt des conditions atmosphériques ambiantes extérieures. Il est donc plus efficace de se représenter les choses en fonction de l’humidité de l’air. L’humidité absolu désigne une quantité de vapeur dans un volume donné d’air humide. Mais comme la capacité de l’air à contenir de la vapeur jusqu’à saturation est limité, comme nous l’avons vu précédemment et que cette capacité maximale va varier en fonction de la température et de la pression atmosphérique (donc de l’altitude), il est préférable de parler d’humidité en valeur relative (c'est à dire en pourcentage).
Quantité de Vapeur et Température
En effet, si la température ou la pression change, l’humidité relative va aussi changer alors que l’humidité absolu, elle, ne variera pas. Dit autrement, l’humidité relative de l’air correspond au rapport de la pression de vapeur contenue dans l'air sur la pression de vapeur saturante à la même température. Elle est donc une mesure du rapport entre le contenu en vapeur d'eau de l'air et sa capacité maximale à en contenir dans ces mêmes conditions.
Saturation de l’Air
Ainsi on dit qu’à 100% d’humidité relative, l’air est à saturation, quel que soit la pression ou la température donné et ne peut donc plus absorber de vapeur supplémentaire. En d’autres termes si nous avons 100% d’humidité relative, c’est que la pression de vapeur partielle (PVP) de l’air est égale à la pression de vapeur partielle saturante (PVPS). Et si nous avons en plus, une eau sous forme liquide à proximité à la même température, est égale à sa tension de vapeur saturante du liquide (TVSL). Lorsque PVP = PVPS = TVSL, les molécules d’eau passent de manière indifférenciée sous forme liquide à gazeuse et vice versa dans un parfait équilibre. Le taux de condensation est alors égale au taux d’évaporation.
Milieu Ouvert
En milieu ouvert, dans un air à 100% d’humidité en contact avec une surface liquide, si l’on varie la température de manière homogène, cela fonctionnera comme avec l’expérience du réservoir (la notion de surébullition en moins). Si la température augmente, l’humidité relative baisse et nous avons reprise de l’évaporation jusqu’à équilibre ou jusqu’à ce que l’humidité relative soit de nouveau de 100% (ou plus). Si la température baisse, l’humidité relative ne pouvant augmenter plus, il y a condensation jusqu’à équilibre ou jusqu’à ce que l’humidité relative soit de 100% (ou moins). Lorsque l’humidité relative est de 100%, les taux de condensation-évaporation s’équilibrent. Notons que lorsque nous sommes à équilibre, les taux seront plus faibles dans un milieu froid et plus important dans un milieu chaud.
Température de l’Air
Lorsque nous sommes à équilibre avec une humidité relative de 100% et que la température augmente de manière hétérogène, il n’y aura pas de différence avec précédemment lorsque c’est seulement la température de l’air qui change :
- 1. Si la température de l’air descend, la capacité maximum de l’air à saturation descend également et donc la pression de vapeur partielle devient momentanément supérieur à cette capacité maximum. Il y a sur-saturation avec une humidité relative supérieur à 100%, donc le taux de condensation prend le dessus.
- 2. Si la température de l’air augmente, la capacité maximum de l’air à saturation augmente également et donc la pression de vapeur partielle devient momentanément inférieur à cette capacité maximum. Il y a sous-saturation avec une humidité relative inférieur à 100%, donc le taux d’évaporation prend le dessus.
Température de l’Eau
En revanche lorsque c’est la température du liquide qui change, les choses vont se passer différemment.
- 3. Si la température de l’eau descend, la TVSL devient inférieur à la pression de vapeur partielle de l’air. Le taux de condensation prend donc le dessus à la surface du liquide. Cette condensation va à son tour faire baisser la pression de vapeur partielle de l’air puisqu’elle capte l’humidité présente dans l’atmosphère pour se réaliser. Puisque la pression de vapeur partielle descend également, elle devient donc inférieur à sa capacité maximum (saturante), qui n’a pas changé. Nous nous retrouvons dans l’air donc avec une sous-saturation comme dans le cas numéro 2. Puisque l’air devient plus sec au-dessus de la surface du liquide, il y a donc reprise d’évaporation. On appelle cela l’assèchement par condensation, c’est ce principe qui est utilisé par les déshumidificateurs de maison (avec un produit plus efficace que de l’eau froide cependant).
- 4. Si la température de l’eau augmente, la TVSL devient supérieur à la pression de vapeur partielle de l’air. Le taux d’évaporation prend donc le dessus à la surface du liquide. Cette évaporation va à son tour faire augmenter la pression de vapeur partielle de l’air puisqu’elle ajoute de l’humidité depuis l’eau liquide vers l’atmosphère pour se réaliser. Puisque la pression de vapeur partielle augmente également, elle devient donc supérieur à sa capacité maximum (saturante), qui n’a pas changé. Nous nous retrouvons dans l’air donc avec une sur-saturation comme dans le cas numéro 1. Puisque l’air devient plus humide au-dessus de la surface du liquide, il y a donc reprise de condensation dans l’air (formation de gouttelette d’eau en suspension dans l’air). On appelle cela un brouillard d’évaporation, c’est ce principe que l’on prend pour de la fumée de vapeur quand on fait bouillir une casserole d’eau (la vapeur d’eau étant en fait invisible).
L’article, trop long, a été divisé en 2 parties. Le prochain article sera donc la suite directe : Les Hydrométéores Orageux 2/2 et traitera en particulier des Gouttelettes Liquide et des Cristaux de Glace.
- Bibliographie :
- - Météo-France : Glossaire
- - Futura-Science : Forum Physique (merci à phys4 en particulier pour les corrections)
- - University Of Arizona : Hydrology & Atmospheric Sciences
- - Aérosols atmosphériques : Propriétés et impacts climatiques - Olivier Boucher